Représentation de Hanes-Woolf
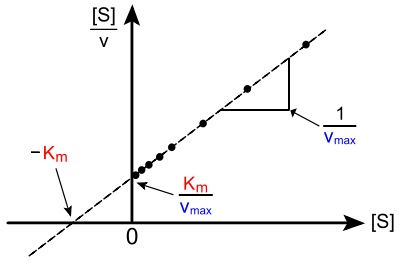
En biochimie, la représentation de Hanes–Woolf est une méthode graphique utilisée en cinétique enzymatique. Elle est basée sur une version linéarisée de l'équation de Michaelis-Menten. Elle consiste à tracer le rapport [S] / v en fonction de [S], où [S] est la concentration initiale en substrat et v est la vitesse initiale de réaction.
Si la loi de vitesse suit l'équation de Michaelis-Menten, alors
où Km est la constante de Michaelis and Vmax est la vitesse maximale de la réaction (à une concentration en enzyme donnée). Dans ce cas, les points expérimentaux s'alignent quand [S] / v est tracé en fonction de [S] ; la droite intersecte l'axe des abscisses à [S] = - KM , et l'axe des ordonnées à [S] / v = KM / Vmax ; sa pente est égale à 1 / Vmax.
Cette représentation est proposée par Charles Hanes en 1932[1]. Cependant, le généticien J.B.S. Haldane attribue la méthode à Barnet Woolf (en)[2].
Cette méthode, où un seul des deux axes nécessite une transformation des données, permet de limiter la propagation des erreurs de mesure. De plus, elle supporte relativement bien[pas clair] une vaste gamme de [S]. Elle est beaucoup moins sensible que la procédure Eadie-Hofstee aux erreurs systématiques de mesure de vitesse v[réf. nécessaire].
La plupart des spécialistes considèrent que, d'un point de vue statistique, c'est la moins mauvaise des méthodes fondées sur une transformation linéaire des données expérimentales[réf. nécessaire].
Démonstration de l'équation
L'equation de Hanes-Wolff peut être démontrée à partir de l'équation Michaelis–Menten:
Inverser et multiplier par [S]:
Réarranger:
Notes et références
- ↑ (en) CS Hanes, « Studies on plant amylases: The effect of starch concentration upon the velocity of hydrolysis by the amylase of germinated barley. », Biochemical Journal, vol. 26, no 5, , p. 1406–1421 (PMID 16744959, PMCID 1261052)
- ↑ (en) J. B. S. Haldane, « Graphical Methods in Enzyme Chemistry », Nature, vol. 179, no 832, (DOI 10.1038/179832b0)
v · m Enzymes | |
|---|---|
| Types |
EC 1 Oxydoréductases :
EC 2 Transférases :
EC 3 Hydrolases :
EC 4 Lyases :
EC 5 Isomérases :
EC 6 Ligases :
EC 7 Translocases (en) :
|
| Modulation | |
| Cinétique |
|
| Thèmes |
|
 Portail de la biochimie
Portail de la biochimie
![{\displaystyle {[S] \over v}={[S] \over V_{\max }}+{K_{m} \over V_{\max }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cfabea4f5fe6b4c2e6533f824b5f15aefc18218)
![{\displaystyle v={{V_{\max }[S]} \over {K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/894c0d8d1c3e9feaf46e8d0f89ae8b7a5cdfc501)
![{\displaystyle {[S] \over v}={{[S](K_{m}+[S])} \over {V_{\max }[S]}}={{K_{m}+[S]} \over {V_{\max }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68233dfb6d5bc6c3fd52e849e5eb2a46e9e0edda)
![{\displaystyle {[S] \over v}={1 \over V_{\max }}[S]+{K_{m} \over V_{\max }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bb781047fcb26179df1b93d6d8c0cde115a59b4)












