リボヌクレアーゼインヒビター
| リボヌクレアーゼインヒビター | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
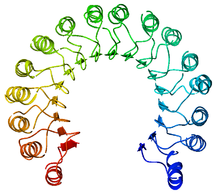 | |||||||||||
| 識別子 | |||||||||||
| 略号 | LRR_1 | ||||||||||
| Pfam | PF00560 | ||||||||||
| Pfam clan | CL0022 | ||||||||||
| InterPro | IPR003590 | ||||||||||
| SMART | SM00368 | ||||||||||
| SCOP | 1bnh | ||||||||||
| SUPERFAMILY | 1bnh | ||||||||||
| |||||||||||
| テンプレートを表示 | |||||||||||
リボヌクレアーゼインヒビター (RI) は450残基、49kDa、等電点4.7のタンパク質である。ロイシンリッチリピートを持ち、特定のリボヌクレアーゼと非常に強固な複合体を形成する。細胞内に0.1%程存在する主要細胞内タンパクであり、RNAの寿命の制御に重要な役割を果たす[2]。
典型的なタンパクには約1.7%のシステインが含まれるが、RIでは6.5%に及ぶため酸化ストレスに敏感である。また、21.5%のロイシンも含み(典型的には9%)、他の疎水性残基、特にバリン・イソロイシン・メチオニン・チロシン・フェニルアラニンの含有量は低い。
構造
典型的なロイシンリッチリピートタンパクであり、骨格に沿ったαヘリックスとβシートの繰り返しで構成されている。これらの二次構造は曲がった右巻き螺旋を形成し、全体として馬蹄形になる。αヘリックスとβシートは平行で、それぞれ馬蹄形の内側と外側の壁を構成している。αヘリックスからβシートに移行する部分にはアスパラギンが存在し、ターンを安定化する。α、βは28、29残基ごとに繰り返され、遺伝子構造に対応した57残基のユニットを形成する(各エクソンは57残基をコードする)。
リボヌクレアーゼとの結合
RIとリボヌクレアーゼの親和性は、おそらく他のどんなタンパク質間相互作用よりも強い。RI-RNase A複合体の解離定数は生理条件下で約20fMであり、RI-アンギオゲニン複合体ではそれより小さい(<1fM)。RIは配列同一性の低い様々なRNasesと結合することができる。構造の研究から、RNaseはRIのC末端と会合し、ちょうど"瓶の栓"のようになっていることが示された。この相互作用は静電的なもので、RNaseの表面積の大部分を埋めている (>25 nm2) 。
リボヌクレアーゼは特に癌細胞に対して毒性、増殖抑制効果を示すため、癌治療薬としての研究が続けられている。だが、RIはどこにでも存在し、RIと結合したリボヌクレアーゼは効果がないことから、これを回避する手段が不可欠となる。ヒョウガエルから得られたRNaseの一種ランピルナーゼ(英語版)(オンコナーゼ)はヒトRIに認識されないようであり、癌治療薬として調査されている[3]。ヒトRNaseを組換え、RNase活性を残しつつもRIに認識されないようにする研究は現在進行中である。
画像
-
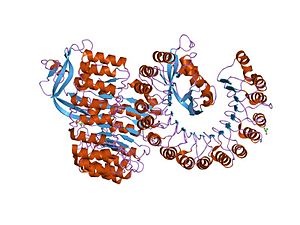 ヒト好酸球由来ニューロトキシン(英語版)との複合体
ヒト好酸球由来ニューロトキシン(英語版)との複合体 -
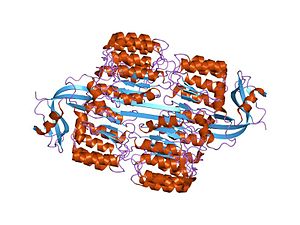 RNase Iとの複合体
RNase Iとの複合体 -
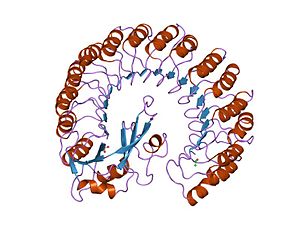 RNase Aとの複合体
RNase Aとの複合体
出典
- ^ PDB: 2BNH; Kobe B, Deisenhofer J (1993). “Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats”. Nature 366 (6457): 751–6. doi:10.1038/366751a0. PMID 8264799.
- ^ Shapiro R (2001). “Cytoplasmic ribonuclease inhibitor”. Meth. Enzymol. 341: 611–28. doi:10.1016/S0076-6879(01)41180-3. PMID 11582809.
- ^ Rutkoski T, Raines R (2008), “Evasion of Ribonuclease Inhibitor as a Determinant of Ribonuclease Cytotoxicity”, Current pharmaceutical biotechnology 9 (3): 185-199, ISSN 1389-2010, PMC 2818677, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2818677
参考文献
- Kobe B, Deisenhofer J (March 1995). “A structural basis of the interactions between leucine-rich repeats and protein ligands”. Nature 374 (6518): 183–6. doi:10.1038/374183a0. PMID 7877692.
- Kobe B, Deisenhofer J (December 1996). “Mechanism of ribonuclease inhibition by ribonuclease inhibitor protein based on the crystal structure of its complex with ribonuclease A”. J. Mol. Biol. 264 (5): 1028–43. doi:10.1006/jmbi.1996.0694. PMID 9000628.
- Papageorgiou AC, Shapiro R, Acharya KR (September 1997). “Molecular recognition of human angiogenin by placental ribonuclease inhibitor--an X-ray crystallographic study at 2.0 A resolution”. EMBO J. 16 (17): 5162–77. doi:10.1093/emboj/16.17.5162. PMC 1170149. PMID 9311977. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1170149/.
- Suzuki M, Saxena SK, Boix E, Prill RJ, Vasandani VM, Ladner JE, Sung C, Youle RJ (March 1999). “Engineering receptor-mediated cytotoxicity into human ribonucleases by steric blockade of inhibitor interaction”. Nat. Biotechnol. 17 (3): 265–70. doi:10.1038/7010. PMID 10096294.
- Shapiro R, Ruiz-Gutierrez M, Chen CZ (September 2000). “Analysis of the interactions of human ribonuclease inhibitor with angiogenin and ribonuclease A by mutagenesis: importance of inhibitor residues inside versus outside the C-terminal "hot spot"”. J. Mol. Biol. 302 (2): 497–519. doi:10.1006/jmbi.2000.4075. PMID 10970748.
- Bretscher LE, Abel RL, Raines RT (April 2000). “A ribonuclease A variant with low catalytic activity but high cytotoxicity”. J. Biol. Chem. 275 (14): 9893–6. doi:10.1074/jbc.275.14.9893. PMID 10744660.










