Ponavljanje bogato leucinom
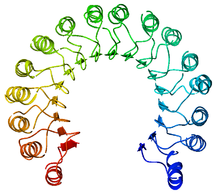 Primer proteina sa ponavljanjem bogatim leucinom, svinjski inhibitor ribonukleaze | |||||||||
| Identifikatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Simbol | LRR_1 | ||||||||
| Pfam | PF00560 | ||||||||
| Pfam klan | CL0022 | ||||||||
| InterPro | IPR001611 | ||||||||
| SCOP | 2bnh | ||||||||
| SUPERFAMILY | 2bnh | ||||||||
| OPM protein | 1xwd | ||||||||
| |||||||||
| Varijanta ponavljanja bogatog leucinom | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Varijanta ponavljanja bogatog leucinom | |||||||||
| Identifikatori | |||||||||
| Simbol | LRV | ||||||||
| Pfam | PF01816 | ||||||||
| Pfam klan | CL0020 | ||||||||
| InterPro | IPR004830 | ||||||||
| SCOP | 1lrv | ||||||||
| SUPERFAMILY | 1lrv | ||||||||
| |||||||||
Ponavljanje bogato leucinom (LRR) je proteinski strukturni motiv koji formira strukturu α/β potkovice.[1][2] On se sastoji od ponavljanja koja su 20–30 aminokiselina duga, i koja su obično bogata u hidrofobnoj aminokiselini leucinu. Tipično, svaka jedinica ponavljanja ima beta lanac-okret-alfa heliks strukturu. Domen formiran od mnogih takvih ponavljanja ima oblik potkovice sa unutrašnjom paralelnom beta ravni i spoljašnjim nizom heliksa. Jedno lice beta ravni i jedna strana niza heliksa su izloženi rastvaraču i stoga su bogati u hidrofilnim ostacima. Region između heliksa i ravni je proteinska hidrofobna osnova i čvrsto je sterično pakovana leucinskim ostacima.
Ponavljanja bogato leucinom često učestvuju u formiranju međuproteinskih interakcija.[3][4]
Vidi još
Reference
- ^ Kobe B, Deisenhofer J (1994). „The leucine-rich repeat: a versatile binding motif”. Trends Biochem. Sci. 19 (10): 415—21. PMID 7817399. doi:10.1016/0968-0004(94)90090-6.
- ^ Enkhbayar P, Kamiya M, Osaki M, Matsumoto T, Matsushima N (2004). „Structural principles of leucine-rich repeat (LRR) proteins”. Proteins. 54 (3): 394—403. PMID 14747988. doi:10.1002/prot.10605.
- ^ Kobe B, Kajava AV (2001). „The leucine-rich repeat as a protein recognition motif”. Curr. Opin. Struct. Biol. 11 (6): 725—32. PMID 11751054. doi:10.1016/S0959-440X(01)00266-4.
- ^ Gay NJ, Packman LC, Weldon MA, Barna JC (1991). „A leucine-rich repeat peptide derived from the Drosophila Toll receptor forms extended filaments with a beta-sheet structure”. FEBS Lett. 291 (1): 87—91. PMID 1657640. doi:10.1016/0014-5793(91)81110-T.
Literatura
- Tooze, John; Brändén, Carl-Ivar (1999). Introduction to Protein Structure (2nd изд.). New York: Garland Publishing.
- Wei T, Gong J, Jamitzky F, Heckl WM, Stark RW, Roessle SC (2008). „LRRML: a conformational database and an XML description of leucine-rich repeats (LRRs)”. BMC Struct. Biol. 8 (1): 47. PMC 2645405
 . PMID 18986514. doi:10.1186/1472-6807-8-47.
. PMID 18986514. doi:10.1186/1472-6807-8-47.
Spoljašnje veze
- SCOP LRR fold
- CATH Alpha-beta horseshoe architecture
- LRRML: a conformational database of leucine-rich repeats
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR012569
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR013210
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR000372
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR000483
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR004830
- Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR004830









