Karbonát
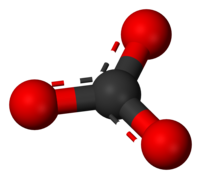
A karbonátok karbonátiont (CO2−3) tartalmazó vegyületek. A karbonátok a szénsav sói. A karbonátion szabályos, síkháromszög alakú, benne a kötésszögek 120°-osak. Az ion delokalizált elektronokat tartalmaz. A szimmetrikus szerkezet és a delokalizált elektronok miatt a karbonátok stabilabbak a szénsavnál. Az alkáliföldfém-karbonátok stabilitása a rendszám növekedésével növekszik, a magnézium-karbonát (MgCO3) például 540 °C-on bomlik el magnézium-oxiddá és szén-dioxiddá, a bárium-karbonát bomlási hőmérséklete lényegesen nagyobb, 1360 °C. A higany(II)-karbonát (HgCO3) már szobahőmérsékleten is bomlik.
Egyes, vízben gyakorlatilag oldhatatlan karbonátok szén-dioxid tartalmú vízben már feloldódnak, hidrogén-karbonát keletkezik.
Fontosabb karbonátok
Az ismertebb természetes karbonátok közé tartozik a kalcium-karbonát (CaCO3), a magnézium-karbonát (MgCO3) és a dolomit (CaMg(CO3)2), melyek kőzetalkotó ásványok. A nátrium-karbonát, vagy szóda (Na2CO3·10H2O) vizes oldatának lúgos kémhatása miatt tisztításra alkalmas, és mivel a kalcium- és magnéziumionokat csapadékként leválasztja, vízlágyítóként alkalmazható.
Források
- Nyilasi János: Szervetlen kémia, Gondolat Kiadó, Budapest, 1975.
Lásd még
- A karbonátok kategóriába tartozó szócikkek
 | Ez a kémiai tárgyú lap egyelőre csonk (erősen hiányos). Segíts te is, hogy igazi szócikk lehessen belőle! |
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap











