Karbonsavak

A karbonsavak az oxigéntartalmú szerves vegyületek egyik csoportját alkotják. Molekulájukban egy vagy több karboxilcsoportot tartalmaznak. A karboxilcsoport összetett funkciós csoport, egy karbonilcsoportból és egy hidroxilcsoportból épül fel. A karbonsavak savjellegű vegyületek, proton leadására képesek. A nyílt láncú, telített monokarbonsavak (egy karboxilcsoportot tartalmazó karbonsavak) homológ sort alkotnak. A legegyszerűbb képviselőjük a hangyasav, továbbiak az ecetsav, a propionsav, és a vajsav. A telített monokarbonsavak homológ sorának tagjait zsírsavaknak is szokás nevezni.
Csoportosításuk
A karbonsavak egyrészt a karboxilcsoporthoz kapcsolódó csoport, másrészt a karboxilcsoportok száma alapján csoportosíthatók. A karboxilcsoporthoz fűződő csoport lehet alifás, cikloalifás, aromás, heterociklusos. A karbonsavak lehetnek telítettek vagy telítetlenek. A karboxilcsoportok száma alapján léteznek mono- (egy karboxilcsoportot tartalmazók), di- (két karboxilcsoportot tartalmaznak), trikarbonsavak (három karboxilcsoport található bennük). Az ecetsav például alifás telített monokarbonsav, a fumársav alifás telítetlen dikarbonsav, a benzoesav aromás monokarbonsav.
Fizikai tulajdonságaik

A karbonsavak forráspontja magas, sokkal magasabb, mint a hozzájuk hasonló molekulatömegű alkánoké. Ez a karbonsavak molekuláinak asszociációjával magyarázható. A karbonsavak karboxilcsopotja hidroxilcsoportot is tartalmaz, ezért hidrogénkötéseket tudnak kialakítani. A karbonsavak dimereket alkotnak, két karbonsavmolekula hidrogénkötésekkel összekapcsolódik egy nyolctagú gyűrűt alkotva. Az ecetsavmolekulák asszociációja olyan erős, hogy az ecetsav gőzeiben is dimerek találhatók.
A karbonsavak olvadáspontjai periodikusan változnak, a páros szénatomszámú zsírsavak olvadáspontja magasabb a páratlan számú szénatomot tartalmazókénál. Ez azzal magyarázható, hogy a páros szénatomszámúak más szerkezetű kristályrácsban kristályosodnak, mint a páratlanok.
A négy legkisebb szénatomszámú karbonsav (hangyasav, ecetsav, propionsav, vajsav) vízzel korlátlanul elegyedik, bennük a karboxilcsoport hidrofil, poláris jellege érvényesül inkább, mint a szénhidrogénlánc hidrofób, apoláris jellege. A szénatomszám növekedésével a szénhidrogénlánc vagy gyűrű apoláros jellege egyre erősebb lesz, a karbonsav vízoldhatósága csökken. Ha a molekulában nincs más poláris jellegű csoport, a nyolc-kilenc szénatomos karbonsavak vízben alig, szerves oldószerekben (alkoholban, éterben) jól oldódnak.
Kémiai tulajdonságaik, karbonsavszármazékok
A karbonsavak reakcióképes vegyületek. Reakciókészségük egyrészt a bennük található karboxilcsoport reakciókészségével, másrészt azzal magyarázható, hogy a karboxilcsoport elektronvonzó hatása miatt lazítja a vele szomszédos szénatomhoz kapcsolódó hidrogénatomot vagy hidrogénatomokat.
Savi jelleg
A karbonsavak savjellegű vegyületek, vizes oldatban protonra és savmaradékionra disszociálnak. Az erős szervetlen savaknál (sósav, kénsav) azonban sokkal gyengébb savak. Bázisokkal sókat képeznek. Sóik vizes oldatban hidrolizálnak, mert a karbonsavak gyenge savak. A karbonsavak erős bázisokkal alkotott sóinak vizes oldata ezért lúgos kémhatású.
A karbonsavak disszociációjának mértéke függ attól, hogy milyen csoport kapcsolódik a karboxilcsoporthoz. Ha a karboxilcsoporthoz elektronszívó hatású csoport kapcsolódik, a karbonsav erőssége nő, ha a csoport elektronküldő, elektrontaszító hatású, a sav erőssége csökken. Az ecetsav például azért gyengébb sav, mint a hangyasav, mert benne a karboxilcsoporthoz a hidrogénatom helyett az elektronküldő hatású metilcsoport kapcsolódik. Viszont az ecetsavban a metilcsoporton lévő hidrogénatomok klórral való helyettesítése a klóratomok elektronszívó hatása miatt növeli a savi erősséget.
Észterek keletkezése
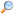 | Bővebben: Karbonsavészter |
Karbonsavak és alkoholok reakciójában észterek képződnek. Ez a folyamat a közvetlen észteresítés. Az észterek képződése megfordítható folyamat, az észterek víz hatására könnyen hidrolizálnak. Az észteresítés állás vagy melegítés hatására megy végbe.
Alkoholokból (és fenolokból) nemcsak közvetlen észteresítéssel képződnek észterek, előállíthatók különböző acilezőszerekkel (savkloridokkal, savanhidridekkel) is. Például alkoholok savkloridokkal észterek képződése közben acilezhetők:
Acilezőszernek savanhidridek is használhatók, ecetsav-anhidrid segítségével például ecetsavészterek állíthatók elő.
Karbonsav-halogenidek
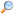 | Bővebben: Savhalogenidek |
A karbonsav-halogenidek a karbonsavakból nyerhetők a karboxilcsoporton belül található hidroxilcsoport halogénnel való helyettesítésével. A legjelentősebbek a savkloridok, ezek karbonsavakból foszfor-pentakloriddal (PCl5) vagy tionil-kloriddal (SOCl2) állíthatók elő.
A savhalogenidek acilezőszerek, az alkoholok és az aminok acilezésére, tehát észterek és amidok előállítására használhatók. Víz hatására könnyen karbonsavvá hidrolizálnak:
Karbonsavanhidridek
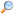 | Bővebben: Savanhidridek |
A karbonsavanhidridek a karbonsavakból keletkeznek vízelvonással. A vízelvonás vízelvonószerek (például ecetsav-anhidrid) vagy 400 °C-on katalizátorok hatására játszódik le.
Dikarbonsavakból intramolekuláris vízelvonással gyűrűs savanhidrid állítható elő. Gyűrűs savanhidrid például a ftálsavból előállítható ftálsav-anhidrid vagy a borostyánkősavból keletkező szukcinanhidrid. Léteznek vegyes anhidridek is, ezek két különböző karbonsav közös anhidridjeinek tekinthetők.
A savanhidridek a savkloridokhoz hasonlóan reakcióképes karbonsavszármazékok. Főként acilezésre használják őket, elsősorban észterek és amidok előállítására.
Karbonsavamidok
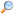 | Bővebben: Amidok |
A karbonsavamidokban a karboxilcsoportban található -OH-csoport NH2-csoportra, vagy annak helyettesített változataira van kicserélve. A karbonsavamidok ammóniából vagy aminokból állíthatók elő acilezőszerekkel.
Savamidok keletkeznek nitrilekből víz hatására is.
Redukció, dekarboxilezés
A karboxilcsoport nehezen redukálható csoport, a karbonsavakból csak erélyes redukció hatására keletkeznek aldehidek vagy primer alkoholok.
A karbonsavak dekarboxilezése a karboxilcsoport szén-dioxid alakjában történő eltávolítását jelenti. A zsírsavak dekarboxilezésekor alkánok keletkeznek. A dekarboxilezés a karbonsav nátriumsójának nátrium-hidroxiddal való hevítésekor játszódik le.
Az élő szervezetben a dekarboxilezési folyamatok enzimek hatására mennek végbe (dekarboxiláz enzimek).
Előfordulásuk, jelentőségük
Karbonsavak a növény- és állatvilágban is előfordulnak. A hosszabb szénláncú alifás karbonsavak (például palmitinsav, sztearinsav, olajsav) a zsírokban és az olajokban fordulnak elő kötötten, észter alakjában. A kisebb szénatomszámúak szabadon vagy sók alakjában találhatók meg. Nagy biológiai jelentősége van a karbonsavak aminoszármazékainak, az aminosavaknak. Az aminosavak a fehérjék építőkövei. Más karbonsavak (például citromsav, tejsav) az anyagcsere-folyamatokban játszanak szerepet.
Előállításuk
A karbonsavak vagy bizonyos vegyületek oxidációjával, vagy karbonsavszármazékokból állíthatók elő. Karbonsavak nyerhetők alacsonyabb oxidációs fokú vegyületek (például szénhidrogének, alkoholok, oxovegyületek) oxidációjával.
Alkánok és alkének erélyes oxidációjakor karbonsavak keletkeznek. Ez a folyamat láncszakadással jár. Benzol oxidációjakor maleinsav-anhidrid keletkezik, amely víz hatására maleinsavvá hidrolizál. A toluol oxidációjával benzoesav állítható elő. Naftalin oxidációjakor ftálsav keletkezik.
Aldehidek és aldehideken keresztül primer alkoholok is karbonsavakká oxidálhatók. A szekunder alkoholok ketonokká oxidálhatók, majd a ketonok oxidációjakor lánchasadás miatt kisebb szénatomszámú karbonsavak keletkeznek.
A karbonsavszármazékok közül az észterek hidrolízisekor karbonsavak és alkoholok keletkeznek. A hidrolízist savval vagy lúggal végzik. A savas hidrolízis folyamata megfordítható. A lúgos hidrolízis során a karbonsavak sói keletkeznek. A karbonsavészterek lúgos hidrolízisét elszappanosításnak is szokás nevezni (általában a trigliceridek hidrolízisére alkalmazzák az elszappanosítás kifejezést, mert ekkor keletkeznek szappanok). A természetben nagy mennyiségben előforduló észterekből, a zsírokból és az olajokból (trigliceridekből) is karbonsavak nyerhetők hidrolízissel, ilyenkor a karbonsav mellett glicerin keletkezik, mint alkohol (pontosabban ilyenkor savas hidrolízis esetén karbonsavak, lúgos hidrolízis esetén a karbonsavak sói keletkeznek, amelyekből erős savval felszabadíthatók a karbonsavak, a karbonsavak nátriumsói a hagyományos szilárd szappanok).
A karbonsavszármazékok közül a savkloridok és a savanhidridek víz hatására könnyen karbonsavakká hidrolizálnak. Nitrilekből savamidokon át is előállíthatók karbonsavak.
Források
- Bot György: A szerves kémia alapjai
- Kovács Kálmán, Halmos Miklós: A szerves kémia alapjai
- Bruckner Győző: Szerves kémia, I/1-es kötet.




















