Nitrogén-monoxid
| Nitrogén-monoxid | |
 Nitrogén-monoxid | |
 Nitrogén-monoxid | |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 10102-43-9 |
| ATC kód | R07AX01 |
| Gyógyszer szabadnév | nitric oxide |
| Gyógyszerkönyvi név | Nitrogenii oxidum |
| Kémiai és fizikai tulajdonságok | |
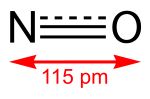
| Kémiai képlet | NO |
| Moláris tömeg | 30,0061 g/mol |
| Megjelenés | színtelen gáz |
| Sűrűség | 1,3 g·cm−3 (folyadék) 1,34 g·dm−3 (gáz) |
| Olvadáspont | −163,6 °C (109,6 K) |
| Forráspont | −151,7 °C (121,4 K) |
| Veszélyek | |
| EU osztályozás | Égést tápláló (O), Nagyon mérgező (T+), Maró (C)[1] |
| NFPA 704 |  0 3 2 OX |
| R mondatok | R8, R26, R34[1] |
| S mondatok | S9, S17, S26, S28, S36/37/39, S45[1] |
| Gyúlékonyság | 0 |
| Rokon vegyületek | |
| Rokon nitrogén-oxidok | dinitrogén-oxid dinitrogén-trioxid nitrogén-dioxid dinitrogén-tetroxid dinitrogén-pentoxid |
| Rokon vegyületek | ammónium-nitrát |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A nitrogén-monoxid színtelen, vízben rosszul oldódó gáz, szervetlen vegyület. Folyékony halmazállapotban színtelen, melyet sok helyen tévesen kék színűnek említenek. Az esetleges kék színt a nyomokban jelenlevő dinitrogén-trioxidtól kapja,[2] szilárd halmazállapotban színtelen. Párosítatlan elektront tartalmaz, ezért paramágneses tulajdonságú.[3]
Kémiai tulajdonságai
Közönséges hőmérsékleten a levegő oxigénjével azonnal vörösbarna színű nitrogén-dioxid keletkezik belőle. Párosítatlan elektront tartalmaz.
Telítetlen vegyület, emiatt a reakciókészsége nagy. Klór hatására nitrozil-kloriddá alakul:
Ha oxigén jelenlétében tömény kénsavban nyeletik el, nitrozil-kénsav képződik.
Előfordulása
A természetben villámcsapások hatására a nitrogén reakcióba lép az oxigénnel, és nitrogén-monoxid keletkezik. Ezt azonban a légkör oxigénje nitrogén-dioxiddá oxidálja. A nitrogén-dioxid víz hatására salétromossavvá és salétromsavvá alakul. Ezért nagy viharok alkalmával kis mennyiségű salétromossav és salétromsav is kerül a levegőbe és az esővízbe.
Előállítása
Előállítása történhet kb. 30%-os töménységű salétromsav és fémréz reakciójával, vagy ammóniagáz oxidációjával 700 °C körüli hőmérsékleten.
Élettani szerepe
 | Bővebben: A nitrogén-monoxid biológiai funkciói |
Az emlősök testében fontos neurotranszmitter. A baktériumok, a növények, gombák és állatok sejtjeiben is keletkezhet, fontos szabályozó szereppel rendelkezik olyan folyamatokban mint pl. antibiotikum-rezisztencia kialakulása, ATP-termelés és sejtlégzés, apoptózis, fotoszintézis, fagocitózis, sejtmozgás; mikorrhiza-növény szimbiózis illetve gomba-alga szimbiózis létrejötte.[4]
Jegyzetek
- ↑ a b c A nitrogén-monoxid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. (JavaScript szükséges) (angolul)
- ↑ N. N. Greenwood, A. Earnshow: Az elemek kémiája II. 604. o.
- ↑ Nyilasi János. Szervetlen kémia. Budapest: Gondolat Kiadó, 175-176 o.. o. (1975)
- ↑ Rőszer, T (2012) The Biology of Subcellular Nitric Oxide. Springer, ISBN 978-94-007-2818-9
 | Ez a kémiai tárgyú lap egyelőre csonk (erősen hiányos). Segíts te is, hogy igazi szócikk lehessen belőle! |
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap












