| FHL1 |
|---|
 |
| Наявні структури |
|---|
| PDB | Пошук ортологів: PDBe RCSB |
|---|
| Список кодів PDB | | 1X63, 2CUP, 2CUR | | |
| Ідентифікатори |
|---|
| Символи | FHL1, FHL-1, FHL1A, FHL1B, FLH1A, KYOT, SLIM, SLIM-1, SLIM1, SLIMMER, XMPMA, RBMX1A, RBMX1B, four and a half LIM domains 1, FCMSU |
|---|
| Зовнішні ІД | OMIM: 300163 MGI: 1298387 HomoloGene: 31038 GeneCards: FHL1 |
|---|
| |
| Пов'язані генетичні захворювання |
|---|
| reducing body myopathy[1] |
| Онтологія гена |
|---|
| Молекулярна функція | • GO:0001948, GO:0016582 protein binding
• transmembrane transporter binding
• зв'язування з іоном металу
• молекулярна функція
|
|---|
| Клітинна компонента | • цитоплазма
• клітинна мембрана
• клітинне ядро
• focal adhesion
• гіалоплазма
|
|---|
| Біологічний процес | • animal organ morphogenesis
• GO:1990376 negative regulation of G1/S transition of mitotic cell cycle
• multicellular organism development
• диференціація клітин
• muscle organ development
• negative regulation of cell growth
• regulation of potassium ion transmembrane transporter activity
• regulation of membrane depolarization
• negative regulation of G2/M transition of mitotic cell cycle
• positive regulation of potassium ion transport
|
|---|
| Джерела:Amigo / QuickGO | |
| Шаблон експресії |
|---|
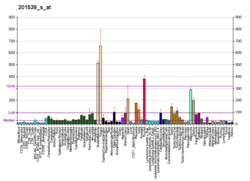

 |
| Більше даних |
| Ортологи |
|---|
| Види | Людина | Миша |
|---|
| Entrez | | |
|---|
| Ensembl | | |
|---|
| UniProt | | |
|---|
| RefSeq (мРНК) | NM_001159699
NM_001159700
NM_001159701
NM_001159702
NM_001159703
| NM_001159704
NM_001167819
NM_001449
NM_001330659
NM_001369326
NM_001369327
NM_001369328
NM_001369329
NM_001369330
NM_001369331 |
| | NM_001077361
NM_001077362
NM_001287800
NM_010211 |
|
|---|
| RefSeq (білок) | NP_001153171
NP_001153172
NP_001153173
NP_001153174
NP_001153175
| NP_001153176
NP_001161291
NP_001317588
NP_001440
NP_001356255
NP_001356256
NP_001356257
NP_001356258
NP_001356259
NP_001356260 |
| | NP_001070829
NP_001070830
NP_001274729
NP_034341 |
|
|---|
| Локус (UCSC) | Хр. X: 136.15 – 136.21 Mb | Хр. X: 55.78 – 55.84 Mb |
|---|
| PubMed search | [2] | [3] |
|---|
| Вікідані |
| Див./Ред. для людей | Див./Ред. для мишей |
|















